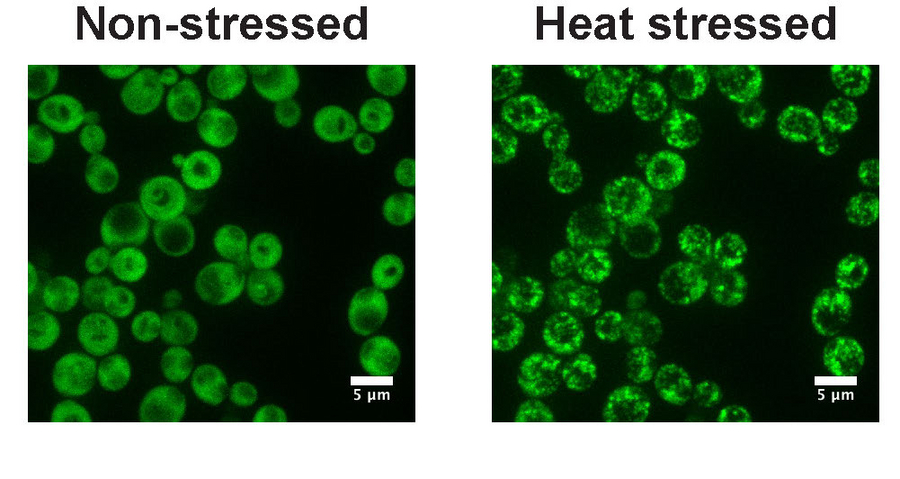
Das Ded1p-Protein der Backhefe geht von einem diffusen Zustand (nichtgestresste grüne Zellen, links) in einen Zustand über in dem es dichte Strukturen (Hitze-gestresste grüne Zellen, rechts) bildet. Der Übergang erfolgt durch den Prozess der Phasentrennung und wird durch eine Erhöhung der Umgebungstemperatur ausgelöst. Das Ded1p-Protein wurde mir einem grün fluoreszierenden Farbstoff genetisch markiert. © BIOTEC
Unsere Umweltbedingungen schwanken stark. In Deutschland zum Beispiel können sich die Temperaturen von eisigen minus 20 Grad Celsius im Winter auf heiße 40 Grad Celsius im Sommer verändern. Organismen, die nicht in der Lage sind, sich an solche Temperaturschwankungen anzupassen, werden nicht überleben und somit ihre genetische Information nicht an die nächste Generation weitergeben. In einer Welt, in der wir aufgrund der globalen Erwärmung mit stetig steigenden Durchschnittstemperaturen konfrontiert sind, müssen wir uns fragen: Wie reagieren Organismen auf veränderte Temperaturen? Welche molekularen Mechanismen nutzen sie dabei?
Aus jahrzehntelanger Forschungsarbeit ist bekannt, dass verschiedene Organismen sehr ähnlich auf Temperaturveränderungen reagieren. Sind sie Hitze ausgesetzt, hören ihre Zellen auf zu wachsen, und sie stellen die Produktion von Eiweißen ein, die für Wachstum und Fortpflanzung notwendig sind. Stattdessen starten sie mit der Produktion von Eiweißen, die die Zellen vor hitzebedingten Schäden schützen. Sprich: Die Zellfabrik stellt ihre Eiweißproduktion um. Unbekannt ist jedoch, wie Zellen den Hitzestress erkennen und welche Mechanismen die Produktionsumstellung anstoßen.
Backhefe als Modellorganismus
Diesen Grundsatzfragen gingen Wissenschaftler des Biotechnologischen Zentrums (BIOTEC) der TU Dresden und des Max-Planck-Instituts für molekulare Zellbiologie und Genetik (MPI-CBG) gemeinsam mit Partnern in Heidelberg und Toronto, Kanada, nach. Sie nutzten dabei einen beliebten Modellorganismus der Zellforschung – den Hefepilz, wie er vom Brotbacken oder Bierbrauen bekannt ist. Dieser Einzeller gibt Einblick in die grundlegenden Prozesse des Lebens, denn er ist nahezu gleich ausgestattet wie Zellen von Mensch und Tier. Wenn die Wissenschaftler die molekularen Prozesse innerhalb der Hefezelle verstehen, können sie auch die Entstehung von Krankheiten in komplexen Organismen wie dem Menschen besser ergründen.
“In der Hefezelle konnten wir ein kritisches Protein, Ded1p, identifizieren, das bei einem Hitzeschock seine Struktur ändert und dann die Zellmaschinerie neu programmiert. Wir haben im Labor das Verhalten von Ded1p mit hochreinen Komponenten nachgestellt und folgendes beobachtet: Unter normalen Bedingungen ist Ded1p gleichmäßig im Zytoplasma der Zellen verteilt, aber wenn die Temperatur steigt, bildet es dichte Strukturen und nutzt dabei den Prozess der Phasentrennung”, erklärt Christiane Iserman, die Erstautorin der Studie. "Die Tatsache, dass Ded1p in der Lage ist, auf Temperaturveränderungen zu reagieren, besagt, dass dieses Protein eine Art Thermometer innerhalb der Zelle ist.”
Des Weiteren sind die Wissenschaftler der Frage nachgegangen, welche Konsequenzen es für die Zelle hat, wenn Ded1p diese dichten Strukturen bildet. “Sie geben der Zelle das Zeichen, nun die Produktion der Eiweiße herunter zu fahren, die für Wachstum und Fortpflanzung zuständig sind, und schleunigst dafür zu sorgen, dass schützende Eiweiße hergestellt werden", erklärt Christine Desroches Altamirano, Zweitautorin der Studie.
Ergebnisse können helfen, neurodegenerative Erkrankungen besser zu verstehen
Dieser ausgeklügelte Mechanismus scheint nicht auf Hefezellen beschränkt zu sein. Die Forscher fanden heraus, dass die Ded1p-Proteine von anderen Organismen gut an die Temperatur des jeweiligen Lebensraumes angepasst sind. “Dies deutet darauf hin, dass die Evolution unsere Zellen mit einer hohen thermischen Sensitivität ausgestattet hat, so dass sich Lebewesen Temperaturschwankungen anpassen können. Das macht uns hoffnungsvoll, dass Organismen mit der globalen Erwärmung umgehen können”, erläutert Simon Alberti, der die Studie leitete und Forschungsgruppenleiter am BIOTEC ist sowie Alumnus des MPI-CBG ist.
Alberti: “Unsere Forschungsergebnisse haben allerdings noch allgemeinere Bedeutung: Wir haben einen Mechanismus innerhalb der Zelle entdeckt, der dem Organismus hilft, mit vielfältigen Veränderungen in der Umwelt umzugehen, nicht nur mit Hitzestress. Zellen scheinen in der Lage zu sein, verschiedenste Umweltsignale aufzunehmen, indem sie Proteine nutzen, die den Prozess der kontrollierten Phasentrennung beherrschen. In weiteren Studien wollen wir nun herausfinden, ob dieser Mechanismus uns hilft, menschliche Krankheiten zu verstehen – vorrangig solche, bei denen unsere Zellen bestimmte Stress-Situationen nicht richtig verarbeiten, wie es bei altersbedingten neurodegenerativen Erkrankungen der Fall zu sein scheint."
Das Forschungsprojekt wurde 2015 initiiert und von der Alberti-Forschungsgruppe am BIOTEC geleitet. Die enge Zusammenarbeit von 19 Wissenschaftlern der TU Dresden, des MPI-CBG in Dresden, der Universität Heidelberg, des Europäischen Laboratoriums für Molekularbiologie in Heidelberg und der University of Toronto in Kanada war zentral für den Erfolg des Projekts. Das Forschungsprojekt wurde von der Max-Planck-Gesellschaft, der TU Dresden, dem MaxSynBio-Konsortium, dem Europäischen Forschungsrat (ERC), dem Human Frontiers Science Program (HFSP), der Volkswagen-Stiftung und dem Boehringer Ingelheim Fonds finanziert. Veröffentlicht wurden die Forschungsergebnisse im renommierten Wissenschaftsjournal Cell.
Christiane Iserman, Christine Desroches Altamirano, Ceciel Jegers, Ulrike Friedrich, Taraneh Zarin, Anatol W. Fritsch, Matthäus Mittasch, Antonio Domingues, Lena Hersemann, Marcus Jahnel, Doris Richter, Ulf-Peter Guenther, Matthias W. Hentze, Alan M. Moses, Anthony A. Hyman, Günter Kramer, Moritz Kreysing, Titus M. Franzmann, Simon Alberti: „Condensation of Ded1p promotes a translational switch from housekeeping to stress protein production”, Cell, 30. April 2020, doi.org/10.1016/j.cell.2020.04.009