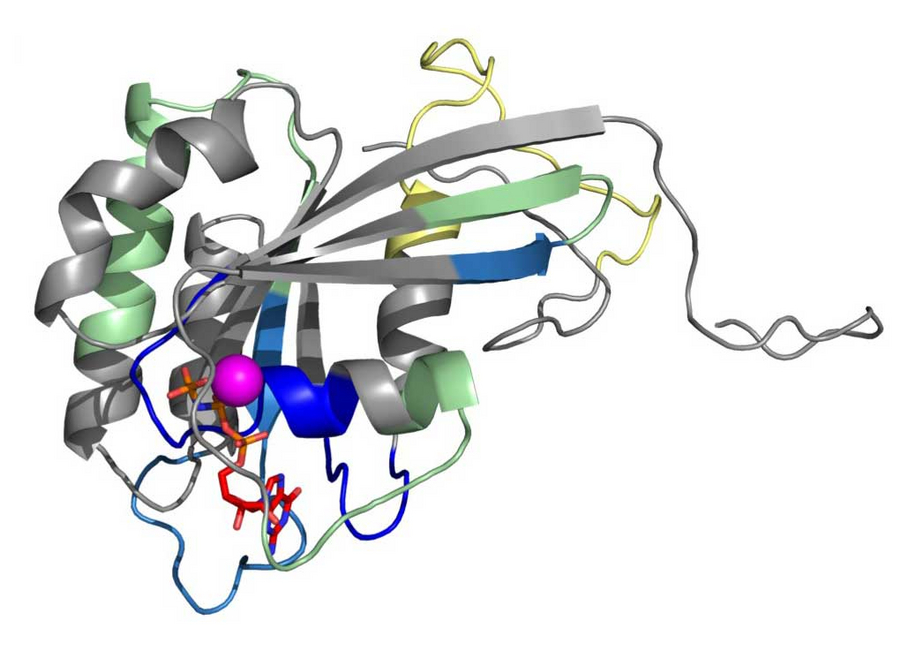
Modell der Rab5-Proteinstruktur, das die strukturellen Veränderungen zeigt, die während der Aktivierung auftreten. Copyright: Cezanne et al., eLife / MPI-CBG & CSBD
Zellen sind geordnet und in verschiedene Kompartimente unterteilt. Die meisten dieser sogenannten Organellen sind durch eine Membran vom Rest der Zelle getrennt, um so spezielle Funktionen zu erfüllen. Dabei sind Membranen sehr strukturiert aufgebaut. Ihre Funktionsweise ist abhängig von biologischen Makromolekülen, Proteinen und Lipiden, die sich in spezifischen Mustern auf Organellenmembranen organisieren können. Das Forschungslabor von MPI-CBG-Direktor Marino Zerial arbeitet an Endosomen, membrangebundenen Organellen, die Moleküle von der Zelloberfläche oder aus der äußeren Umgebung aufnehmen und in der Zelle verteilen, ähnlich wie ein Postamt. Eine solche Sortierung ist auch davon abhängig, wie die Membran selbst in getrennte Kompartimente oder Subdomäne unterteilt wird.
Eines der Schlüsselproteine, die die Aktivität des Endosoms regulieren, ist Rab5. Dabei dient Rab5 als molekularer Schalter, der zwischen einem Aus-Zustand (inaktiv) und einem Ein-Zustand (aktiv) wechselt. Eine frühere Studie der Forschungsgruppe von Marino Zerial stellte die Hypothese auf, dass die Schalteraktivität von Rab5 auf dem Endosom verstärkt werden kann. Dadurch kann Rab5 gemeinsam mit anderen Proteinen Subdomänen auf der Membran des Endosoms bilden. Um diese Hypothese experimentell zu bestätigen, kooperierten die Forscher der Zerial-Gruppe mit der Gruppe von Ivo Sbalzarini am MPI-CBG, dem Zentrum für Systembiologie Dresden und der TU Dresden. Mit einem minimalen Proteinsatz bildeten die Forscher den Musterbildungsprozess von Proteinen auf künstlichen Membranen nach. Ansätze wie dieser erlauben es Forschern, einen Prozess in einer kontrollierten Umgebung zu untersuchen und gezielt zu steuern. Anastasia Solomatina aus der Gruppe von Ivo Sbalzarini unterstützte die experimentellen Arbeiten durch die Entwicklung neuartiger Bildanalysemethoden zur Auswertung räumlicher Muster auf einer 3D-Oberfläche.
Alice Cezanne, die Erstautorin der Studie, erklärt: „Wir fanden heraus, dass das Rab5-Protein eine Art positive Feedback-Schleife erzeugt: Durch die Interaktion mit einem anderen Proteinkomplex wird Rab5 'angeschaltet', nachdem es an die Lipidmembran bindet. Dadurch werden weitere Rab5-Proteine an die gleiche Stelle der Membran gezogen. Auf diese Weise beschleunigt Rab5 die Bildung von funktionellen 'Domänen' auf der Oberfläche des Endosoms, die für die Aufnahme von Material in das Endosom und die weitere Sortierung und korrekte Lieferung dieses Materials wichtig sind.“
Ein weiteres Ergebnis der Studie ist, dass die Bildung solcher Proteindomänen auf der Membran nicht nur ein proteingesteuerter Prozess ist. Auch die Lipidmembran spielt eine wesentliche Rolle dabei. „Wir haben entdeckt, dass mehrere bestimmte Lipide in der Membran vorhanden sein müssen, damit sich Rab5-Domänen bilden können“, sagt Alice. „Wir gehen davon aus, dass dies nicht nur für Rab5 gilt, sondern auch für viele andere Proteine, die eine ähnliche Fähigkeit zur Selbstorganisation und zur Musterung von Membranen haben.“
Alice Cezanne, Janelle Lauer, Anastasia Solomatina, Ivo F Sbalzarini, Marino Zerial: A non-linear system patterns Rab5 GTPase on the membrane. eLife, 8 June 2020. doi: 10.7554/eLife.54434