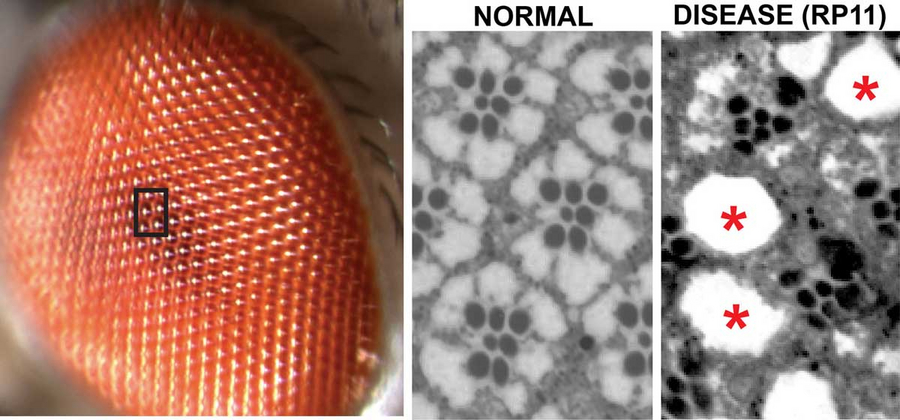
Aufnahme des Facettenauges der Drosophila melanogaster mit mehrfach wiederholten Einheiten von Netzhautzellen. Der schwarze Kasten ist in den mikroskopischen Bildern auf der rechten Seite vergrößert und zeigt Ausschnitte eines normalen und eines degenerativen (RP11-Krankheit) Fliegenauges. Der Verlust von Netzhautzellen ist durch Löcher (*) und desorganisierte Einheiten erkennbar. © Hebbar et al. / MPI-CBG
Retinitis Pigmentosa (RP) ist eine erbliche neurodegenerative Netzhautdegeneration, die zur Erblindung führt. Weltweit ist einer von 3.000 – 8.000 Menschen betroffen. Diese werden zuerst nachtblind, später verlieren sie das periphere Gesichtsfeld (Tunnelblick) und erblinden schließlich fast vollständig. Heute sind mehr als 40 Gene bekannt, deren Mutationen mit der Entstehung von RP assoziiert sind.
Die Fruchtfliege als Modell für menschliche Krankheiten
Die Forschungsgruppe von Elisabeth Knust am Max-Planck-Institut für molekulare Zellbiologie und Genetik in Dresden beschäftigt sich mit der Aufklärung von Mechanismen, die der Netzhautdegeneration zugrunde liegen. Zusammen mit Sarita Hebbar, Postdoktorandin im Forschungslabor, und Malte Lehmann, einem ehemaligen Mitarbeiter und zurzeit Postdoktorand und Arzt an der Charité in Berlin, hat die Gruppe eine spezifische RP, RP11, bei der Fruchtfliege, Drosophila melanogaster, untersucht. Sie erzeugten Fliegen mit einer definierten Mutation im Gen Prpf31. Mutationen in dem entsprechenden menschlichen Gen sind ursächlich an der Entstehung von RP11 beteiligt. Die Forscher veröffentlichten ihre Studie in der Fachzeitschrift „Biology Open.“ Sie erklären: „Fliegen, die eine Mutation in diesem Gen tragen, erblinden. Obwohl die Fliegennetzhaut und die menschliche Netzhaut strukturell unterschiedlich sind, sind ihre Bausteine und viele Gene, die für die Funktion nötig sind, während der Evolution erhalten geblieben. Durch die Modellierung von Krankheiten bei Fliegen können Fragen nach dem Beginn und dem Alters-bedingten Fortschreiten von Krankheiten und deren zelluläre Grundlagen in einem lebenden Organismus untersucht werden, was so in Zellkulturen nicht möglich ist.“
Genetisches Material in Einzelteile zerlegen
Das vom Prpf31 Gen kodierte Protein wird in vielen Geweben unseres Körpers gebildet und spielt eine Rolle bei der Entstehung der sogenannten Boten- (messenger) RNA (mRNA). Die Boten-RNA enthält die Anleitung zur Herstellung von Proteinen, die verschiedene Funktionen in einer Zelle ausführen. Reife mRNA entsteht, wenn eine längere RNA in kleinere Stücke zerschnitten wird und diese Abschnitte dann zu kodierenden mRNAs verbunden werden. Dieser Prozess wird Spleißen genannt, und das Prpf31 Protein ist Teil der zellulären Spleiß-Maschinerie. Die Autoren ergänzen: „Eine Störung des Spleißens führt zu mRNAs, die Proteine mit keinen oder defekten Funktionen bilden. In unserer Studie beschreiben wir die Auswirkungen von Prpf31 Mutationen im Fliegenauge. Wir konnten zeigen, das Mutationen im Drosophila Prpf31 Gen zur Degeneration der Netzhaut führt. Dies geht einher mit einer erhöhten Menge von Rhodopsin, dem lichtsensitiven Protein, das essentiell für den Sehprozess ist. In der Tat verhindert eine experimentelle Reduzierung der Rhodopsinmenge durch Aufzucht der Tiere ohne Vitamin A, das nötig für die Synthese von aktivem Rhodopsin ist, die Netzhautdegeneration der mutanten Fliegen“.
Diese Ergebnisse ebnen den Weg für zukünftige Forschungen. Mit Hilfe des Fliegen Modells für RP11 kann nun die Rolle von Prpf31 genauer aufgeklärt werden, im Auge und in anderen Geweben. Es könnte Forschern helfen zu verstehen, warum das Auge besonders anfällig für Defekte beim Spleißen ist. Elisabeth Knust, die Studienleiterin, fügt hinzu: „Diese Fliegen bieten auch die Möglichkeit, die Regulation von Rhodopsin genauer zu untersuchen, da bekannt ist, dass andere menschliche Netzhauterkrankungen mit einer Störung in der Rhodopsin-Synthese bzw. seinem intrazellulären Transport assoziiert sind.“
Sarita Hebbar, Malte Lehmann, Sarah Behrens, Catrin Hälsig, Weihua Leng, Michaela Yuan, Sylke Winkler, Elisabeth Knust: Mutations in the splicing regulator Prp31 lead to retinal degeneration in Drosophila. Biology Open 2021 doi: 10.1242/bio.052332, Published 25 January 2021